通讯作者:王海梁,Joseph S. Francisco
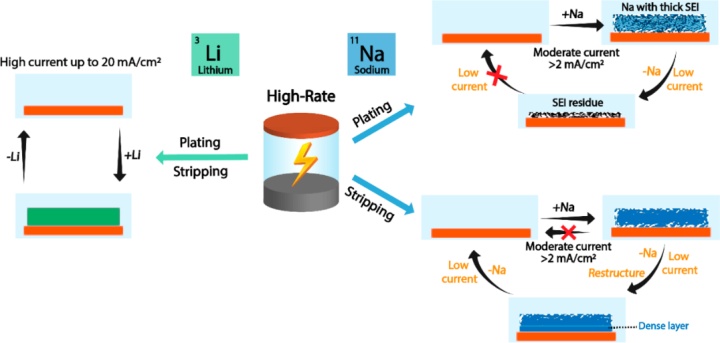
研究表明,作为锂金属负极的低成本替代材料,钠金属负极在高能量电池中的应用越来越受到关注。钠金属电池充/放电电流密度通常小于3mA/cm。随着充放电倍率的增加而导致的容量减少具有动力学起源,当电流密度降低时可以恢复。尽管已经为提高钠金属电极的可逆性和循环寿命进行了广泛的研究,但它们的倍率性能,即高电流下钠金属的沉积/剥离,尚未得到充分探索。
鉴于此,美国耶鲁大学王海梁教授和宾夕法尼亚大学Joseph S. Francisco教授(共同通讯作者)报道了钠金属电极,与更广泛研究的锂金属电极可承受高达20 mA/cm的高电流密度不同,其不能在普通醚类电解液中快速充/放电。快速充电,即金属沉积,会因电解液分解产生非活性Na(I);快速放电,即金属剥离,会因局部Na剥离导致电极与集流体电接触不良。虽然快速充电容量损失是永久性的,但快速放电造成的容量损失可以通过在低放电电流下进行恢复。此外,本文进一步揭示了Na金属电极差的倍率性能与Na本身物理化学性质有关。这项研究描绘了Na在快速沉积/剥离中受到限制的机制起源。相关研究成果“Mechanistic Insights into Fast Charging and Discharging of the Sodium me
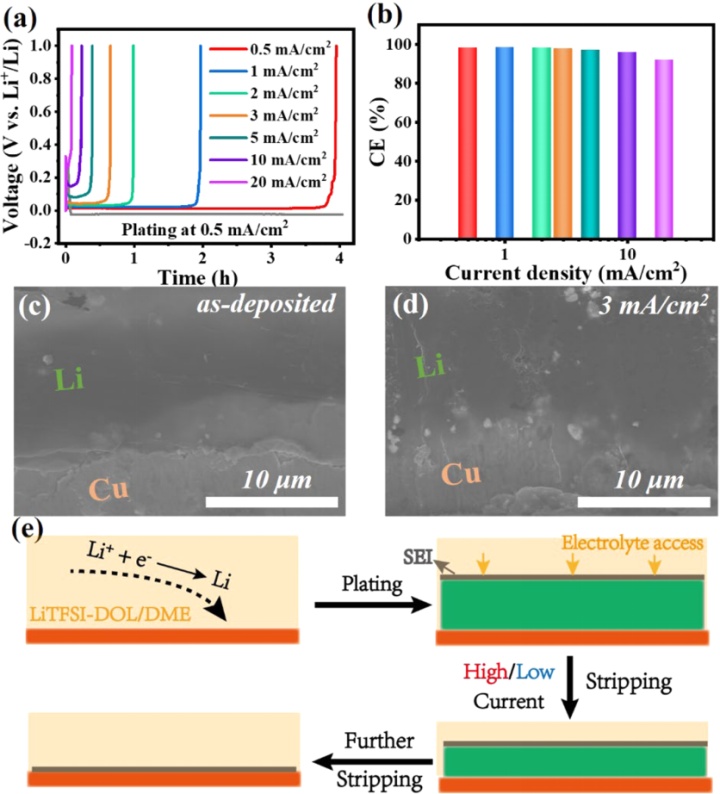
本文研究了锂和钠金属电极在醚类电解液中的快速充/放电行为,并揭示了这两种金属之间的倍率性能差异(图1)。锂金属电极在高达20 mA/cm的高电流密度范围内表现出可逆充/放电。相反,当电流>2 mA/cm时,Na金属电极不能完全充/放电。在中等电流下,由此产生的非活性金属钠并不是永久“死亡”的,它可以通过在低剥离电流下重构来重新激活。密度泛函理论 (DFT) 计算表明,与Li相比,Na的不利剥离行为源于其较低的表面能和剥离能。当以高倍率充电时,沉积的Na含有大量来自电解液分解产生的永久性失活的Na,导致电极失效。
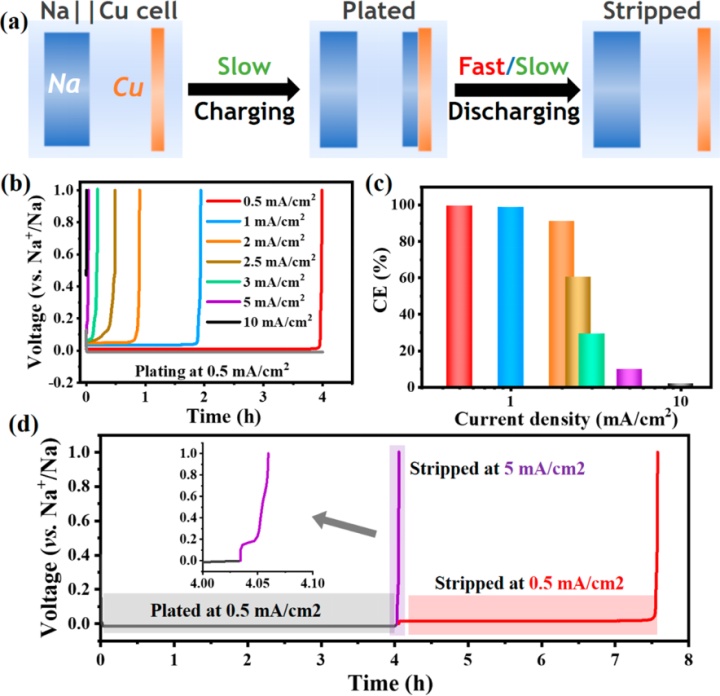
为了研究放电倍率性能,Na||Cu电池使用一种协议进行测试,其中充电电流(即金属沉积)保持恒定在0.5 mA/cm,并且随后放电步骤(即金属剥离)在0.5到10 mA/cm之间变化(图2a)。结果表明,电池在2 mA/cm具有正常的剥离行为,放电电压趋平(图2b,c)。在更高的电流密度下,放电过电位显著增加(图2b);有趣的是,快速放电中损失的容量在低倍率下仍然可用。例如,在以5mA/cm放电结束后(达到1 V),电极可以进一步以0.5mA/cm的低电流放电,最终恢复93.9%损失的容量(图2d)。此外,发现低倍率放电过程重新激活电极以进行快速放电。
图2.(a)钠金属电极的倍率性能测量示意图;(b,c)Na||Cu电池以0.5mA/cm充电,然后在不同电流密度下放电的电压曲线和CEs;(d)Na||Cu电池在0.5mA/cm下充电,5mA/cm下放电,然后在0.5mA/cm充电的电压曲线。
此外,为了了解钠金属负极的放电倍率性能,探究了钠沉积/剥离过程不同阶段的钠形貌。该Na金属层可以在0.5 mA/cm以接近100%的高CE下完全剥离,当以3 mA/cm的高电流密度剥离时,只能获得约30%的低CE(图2c)。作为对比,本文还将0.5mA/cm的低电流下剥离已沉积的Na金属薄膜,达到30%的截止CE,剩余的Na在靠近Cu的区域表现出致密的结构(图3c)。结果表明,在低电流时,金属Na层来重构的底部成更致密的结构,加强了与铜的电接触,使其能够完全剥离Na。然而,在高电流下,Na保持初始晶须结构,底部的Na剥离导致大孔隙,恶化Na层与Cu之间的电接触,从而抑制进一步剥离(图3 d)。由于沉积的Na层的多孔结构允许电解液渗透,因此可以在Cu附近剥离Na。
图3.(a-c)Na在Cu上以0.5mA/cm预沉积,以3mA/cm剥离,以0.5mA/cm剥离至CE为30%的截面SEM图像;(d)不同电流密度下的钠沉/剥离示意图;(e,f)在5,3和2.5mA/cm剥离后,以及在0.5mA/cm2剥离志CE伟10%、30%和60%的SEM图像。
相比之下,锂金属负极显示出明显不同的倍率性能。图4a、b总结了Li||Cu电池在高达20 mA/cm的超高电流密度的性能。虽然放电过电位随电流增加,但仍保持电压平台。SEM图像显示,所沉积的锂层致密。与Na不同的是,当30%的Li电极在3mA/cm电流下被剥离时,其形貌/结构不会改变,并保持与Cu的紧密接触(图4 d)。由于结构致密,其防止电解液渗透,锂剥离只能从顶部表面。因此,锂金属层和Cu集流体之间的电接触是稳定的,这也是钠金属电极无法达到高放电倍率性能的原因。
图4.(a,b)Li||Cu电池以0.5mA/cm充电,然后在不同电流密度下放电的电压曲线和CEs;(c,d)预沉积的锂和剥离30%的Li金属后的横截面SEM图像;(e)Li剥离示意图。
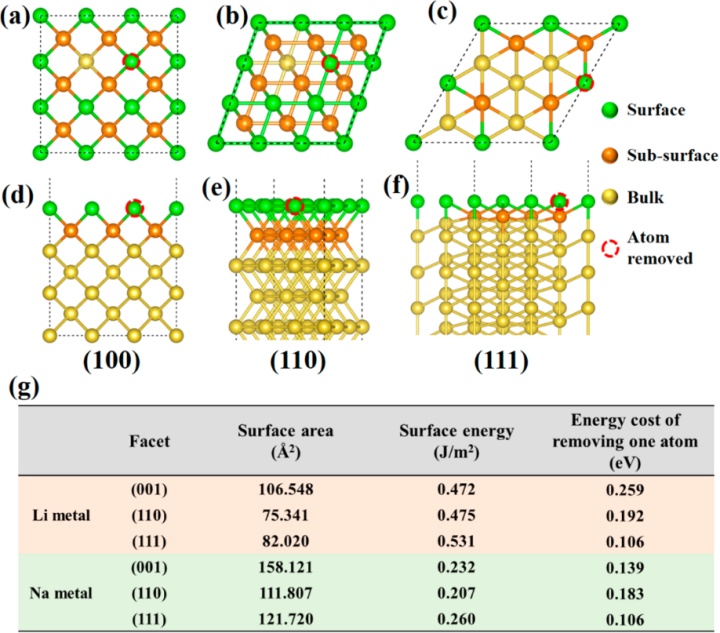
基于DFT计算以阐明Li和Na金属电极之间的放电倍率性能差异,计算了其最常见的平面的表面能(图5a-f)。研究表明,Li的表面能通常比Na的表面能大(图5g),源于Li的原子尺寸较小。Na的较低表面能允许形成具有大表面积的晶须结构。然而,Li沉积倾向于形成致密结构以最小化表面能。此外,本文计算了从两种金属表面去除一个原子所需的能量,以模拟放电过程。锂原子的去除比Na原子的去除更消耗能量(图5g),即:Li(001)为0.259eV,Na(110)为0.183eV,表明Na原子可以很容易地在局部位置被去除,解释了在快速放电过程中有害孔隙形成。
图5.(a-f)bcc结构的Li或Na金属不同面的顶部和侧视图;(g)不同面的表面积和表能量的总结,以及从各自的表面去除一个Li或Na原子所需要的能量。
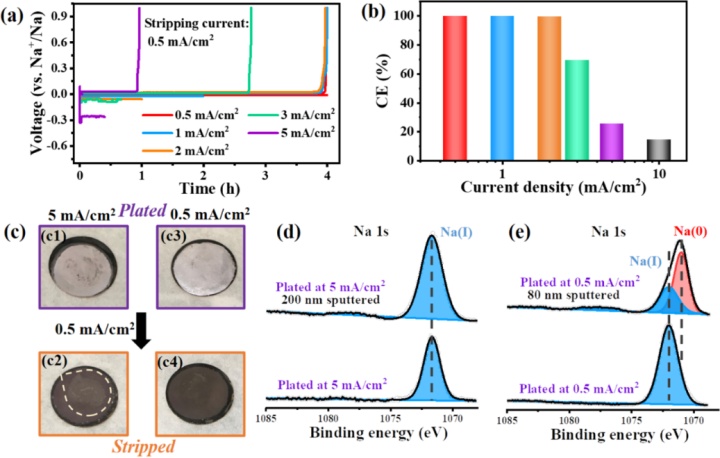
此外,钠金属电极的快速充电行为也被研究。Na||Cu电池以0.5至5mA/cm的不同电流密度充电,随后以0.5mA/cm放电。虽然0.5和5mA/cm的沉积形貌相似,但高电流密度下不具有金属光泽(图6 c1,3),表明该层的很大一部分是来自电解液分解的离子/有机物质。
然后基于XPS分析沉积Na的组成。表面主要非活性钠Na(I) 组成,与沉积电流无关(图6 d,e)。进一步溅射电极以研究整体成分。从表面移除200 nm层后,以5 mA/cm充电的电极仍然没有显示出金属钠的迹象(图6d),即在快速充电过程中存在严重的电解液分解。因此,得出结论,Na金属电极在快速充电条件下的失效是由于副反应导致的。电解液在高充电倍率下的分解可能与钠电解液的离子电导率相对较低(比锂1个数量级)有关,在高电流密度下不能选择性沉积钠。
图6.(a,b)Na||Cu电池以不同电流密度下放电,然后以0.5mA/cm充电的电压曲线和CEs;(c)Na以5mA/cm沉积(c1),然后以0.5mA/cm剥离(c2)和沉积/剥离都以0.5mA/cm进行的照片;(d,e)以5 mA/cm和0.5 mA/cm沉积的Na的XPS光谱。
总而言之,与锂金属电极相比,钠金属电极表现出更低的充放电倍率性能。研究表明,底部的Na被剥离导致大孔隙,恶化Na层与Cu之间的电接触,从而抑制进一步剥离。同时失去的容量可以在低剥离电流密度下的致密化过程中重新激活。此外,快速的充电性能受到严重的电解液分解的影响,产生了大量的非活性金属钠。在此基础上,本文提出可以考虑制造三维电极和电解液工程等方法来提高Na金属电极的倍率性能。前一种策略可以降低局部电流密度,加强电接触,而后者可以缓解副反应。
Yiren Zhong, Qiuwei Shi, Cho 2021, DOI:10.1021/jacs.1c06794






 广告
广告